利用“加减法”巧解化学高考题
墨桃耘李
有许多化学内容具有隐含的数量关系,挖掘这些内在的数量关系,利用“加减法”进行解题,往往能够化繁为简,提高我们的解题效率。
一.利用加减法求电极反应方程式
如果已知电池反应的两个电极反应式,则它们相加就是电池总反应式。反之,如果已知电池反应的总反应式,可先写出较易书写的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的电极反应式,即得到较难写出的电极反应式;这就是所谓的“加减法”。

二.利用加减法求反应的焓变。
盖斯定律认为,如果一个总的反应由两个分反应相加减得到,那么总反应的焓变等于两个分步反应焓变的和或者差。
(山东理综28)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g)ΔH=-1160 kJ·mol-1
若用标准状况下4.48 LCH4还原NO2至N2,整个过程中转移的电子总数为阿伏伽德罗常数用NA表示),放出的热量为kJ。
【解析】CH4还原NO2至N2,可以把两个分步反应直接相加而得到2CH4(g) +4NO2(g)=2N2(g)+2CO2(g) +4H2O(g) ΔH=-1734 kJ·mol-1,CH4中的C的化合价为-4价,CO2中C的化合价为+4价,所以每有由2mol甲烷发生反应转移16 mol的电子,标准状况下4.48 LCH4的物质的量为0.2mol,所以转移的电子的总数为1.60NA,由总的方程式可知2mol甲烷发生反应放出热量为1734 kJ,所以0.2mol甲烷完全反应放热173.4 kJ。
【答案】1.60NA(或1.6NA)173.4;
【误区警示】有的分反应在再相加减之前方程式两边需要同时乘以或者除以某个数,焓值也要相应的乘以或者除以这个数。
三.由原子序数推断元素在周期表中的位置。
记住周期表中各周期所含的元素各类,用原子序数减去各周期所含元素种类,到不够减时止就可确定出周期数,余数为元素所在的纵行数,根据各纵行所对应的族数确定。如16号元素:16-2-8=6,该元素应在第3周期,第六个纵行即第6主族。又如51号元素:51-2-8-8-18=15,当减去前四周期的元素种数时所得余数为15,已不能再减去第五周期的元素种数18,所以该元素应在第5周期,第十五个纵行即第5主族。
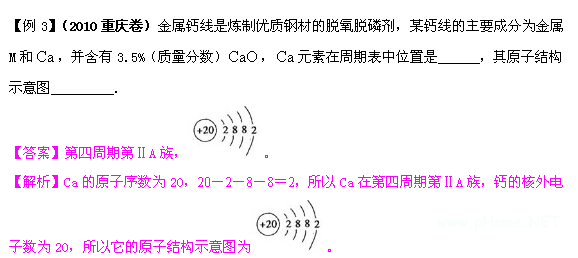
【误区警示】该法能方便的确定周期序数,然而不能快速确定元素的族序数,对于P区元素来说,由于余数较多容易出错,特别是对于第六第七周期时要考虑镧系和锕系元素的特殊情况更容易出错。
四.利用加减法确定有机物的分子式。
在做有机推断题的时候,同学们大都从官能团的性质入手,然而有机物之间一些量的关系也是也是做这类题目的重要突破口,比如:
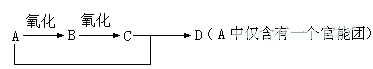
这是有机化学中常考的一条知识线索,各种物质的分子量之间存在着特定的量的关系,M(B)+2= M(A); M(B)+16=M(C); M(A) + M(C)= M(D)+18;在做具体的题目时,我们可以用这些等式用“加减法”求未知物质的分子量,进而确定其分子式。
【例4】[2012·浙江理综化学卷]化合物A(C12H16O3)经碱性水解、酸化后得到B和C(C8H8O2)。C的核磁共振氢谱表明含有苯环,且苯环上有2种氢原子。B经过下列反应后得到G,G由碳、氢、氧三种元素组成,相对分子质量为172,元素分析表明,含碳55.8 %,含氢7.0 %,核磁共振氢谱显示只有一个峰。
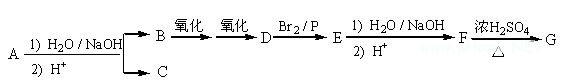


五.利用加减法剖析反应的本质。
有的化学反应分很多步骤完成,这让我们对各个步骤中各种物质所起的作用认识模糊,倘若我们把各分步反应相加,消去某些中间产物,则会使这个化学反应变的简洁、直观,从而加深我们对反应本质的理解。
【例5】1995年诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家。大气中的臭氧层可滤除大量的紫外光,保护地球上的生物。氟利昂(如CCl2F2)可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应为:①O3→O2+O②Cl+O3→ClO+O2③ClO+O→Cl+O2在上述臭氧变成氧气的反应过程中,Cl是()
A.反应物B.生成物C.中间产物D.催化剂
【解析】将①、②、③相加可得总的方程式为2O3→3O2,由此我们可知一开始Cl参与了化学反应,但是最后还是Cl,反应前后质量和化学性质都不发生变化,因此Cl是催化剂。
【答案】D
【知识拓展】有的高考题考查学生的逆向思维,已知总的反应,让学生书写分步反应,这时根据总的反应的反应物和生成物,可以很轻松的书写出分步部反应。比如09年宁夏卷考查V2O5对SO2的催化作用,V2O5的催化循环机理为V2O5氧化SO2时,自身被还原为四价钒化合物SO2 +V2O5=SO3+2VO2,四价钒化合物再被氧气氧化4VO2+ O2=2V2O5。


 微信收款码
微信收款码 支付宝收款码
支付宝收款码